Bartosz Prędota
Koło Naukowe Biologii Molekularnej UW
Drogi czytelniku, droga czytelniczko,
jeżeli przeczytałeś część pierwszą i teraz zabierasz się za drugą, pragnę złożyć wyrazy uznania dla Twoich pokładów ciekawości. Jeżeli natomiast nie zapoznałeś się z poprzednim artykułem omawiającym pochodzenie wirusa, jego budowę, diagnostykę i patogenezę to z tego miejsca zachęcam Cię do lektury, ponieważ pozwoli Ci to trzeźwiejszym spojrzeniem ogarnąć następujący artykuł. Utwór ten traktuje o wybranych terapiach farmakologicznych, jak wskazuje tytuł, zatem nie bierze pod uwagę terapii naturalnych, w tym chińskiej medycyny alternatywnej proponowanej przez grupę badaczy Yanfang Xianab i wsp. w badaniu Bioactive natural compounds against human coronaviruses: a review and perspective. Mimo to, umieszczam wspomniane badanie w przedmowie, jeżeli czytelnik zapragnąłby poszerzyć swoją wiedzę w tym zakresie. Przejdźmy zatem do rzeczy. Tym razem Dostojewski milczy niczym głaz.
Chlorochina (CLC)
CLC jest pochodną chinoliny i początkowo stosowano ją jako lek przeciw malarii ze względu na jej działanie pierwotniakobójcze (mianem pierwotniaka niegdyś nazywano protisty odzwierzęce). Jej hydroksylowa pochodna nosi nazwę hydroksychlorochina (HCLC) i wraz z CLC używana jest w terapiach schorzeń autoimmunologicznych.
Zarówno CLC, jak i HCLC, są słabymi zasadami, przez co gromadzą się w dużej ilości w organellach o niskim pH takich jak endosomy, lizosomy czy aparat Golgiego. Podwyższenie pH powoduje zakłócenie funkcjonowania enzymów np. kwaśnych hydrolaz, a także hamuje obróbkę potranskrypcyjną. Ma to kluczowe znaczenie dla pełnienia roli leków antywirusowych, ponieważ zaburzenie działania hydrolaz w endosomach nie pozwala na przecięcie glikoproteiny S i wydostania się wirusa do cytoplazmy. Ponadto, zaburzając pracę glikozylotransferazy w aparacie Golgiego, uniemożliwiają powstanie funkcjonalnych glikoprotein otoczki wirionu, co czyni go niegroźnym.
Dodatkowo, HCLC posiada zdolność obniżania produkcji zarówno cytokin prozapalnych np. TNF-α, jak i ich receptorów, m.in. poprzez blokadę szlaków sygnałowych p38, JNK oraz NF-κB.
Badanie in vitro na linii Vero E6 wykazało następujące cechy CLC:
- hamuje infekcję SARS-CoV-2 oraz charakteryzuje się działaniem immuno-modulującym, co może synergistycznie wzmocnić efekt in vivo;
- po podaniu doustnym dochodzi do szerokiej dystrybucji substancji w organizmie, w tym w tkance płucnej.
Badania kliniczne potwierdziły wspomniany pozytywny efekt. Dowiedziono, iż CLC łagodzi przebieg zapalenia płuc, poprawia obraz radiologiczny i skraca czas trwania choroby. Należy jednak pamiętać, że wszelkie terapie z użyciem tej substancji przeciwko COVID-19 muszą być prowadzone w szpitalu pod nadzorem lekarza – wbrew temu, co sugeruje Donald Trump, prezydent USA.
Remdesivir
Jest to analog nukleotydu, który swoje przeciwwirusowe działanie wykazuje podwójnie. Po pierwsze, co wynika z nazwy, łączy się on z replikowanym łańcuchem nukleotydowym, powodując jego przedwczesną terminację. Po drugie, jest on w stanie zablokować polimerazę DNA lub RNA, uniemożliwiając kontynuowanie replikacji. Charakteryzuje się szerokim spektrum działania, pierwotnie wykorzystywany był w terapii skierowanej przeciwko wirusowi Ebola.
GS-5734, czy RD to remidesivir w formie proleku, który po przedostaniu się do komórki przechodzi w formę aktywną poprzez fosforylację. Poprzednio testowane analogi nukleotydów nie zdały egzaminu ze względu na aktywność egzonukleazy występującej w SARS-CoV-2, jednakże aktywna forma remidesiviru blokuje jej funkcjonowanie.
Niestety, wbrew obiecującym wynikom uzyskanym w badaniu in vitro, badanie kliniczne wykazało niemalże zerową skuteczność leku, która porównywalna była z grupą kontrolną. Mimo to, odpowiednio wczesne jego podanie, tzn. do 10 dni od wystąpienia objawów, przyspiesza ustąpienie choroby o 5 dni (mediana). Co ciekawie, skutki uboczne były obserwowane z podobną częstotliwością zarówno w grupie badawczej, jak i kontrolnej.
Interferony typu I
Zaliczają się do nich m.in. IFN-α oraz IFN-β. Związki te naturalnie wydzielane są przez komórki odpornościowe w reakcji na infekcję wirusową. Mechanizm odpowiedzi przeciwwirusowej z udziałem interferonu wygląda następująco:
1. Połączenie IFN typu I z receptorem IFNAR występującym na większości komórek organizmu.
2. Fosforylacja czynników transkrypcyjnych, np. STAT1.
3. Aktywacja ISG (ang. interferon-stimulated genes).
4. Hamowanie cyklu replikacyjnego i rozprzestrzeniania wirusa poprzez spowolnienie metabolizmu komórkowego, wzrost wydzielania cytokin prozapalnych oraz ekspresji receptorów rozpoznających materiał genetyczny wirusa.
Używane są zwykle w wypadku infekcji wirusowej o nieznanej etiologii i działają najlepiej jako profilaktyka we wczesnym stadium choroby. Stosowany w ten sposób IFN typu I skutkuje spadkiem intensywności replikacji SARS-CoV-2, jednak jest bezsilny wobec jego starszego brata. Różnica ta tłumaczona jest interferencją SARS-CoV ze szlakami związanymi z IFN, co jest to dosyć ironiczne z uwagi na fakt, iż interferencja wirusa w szlak interferonu uniemożliwia substancji interferencję w replikację wirusa.
Leczenie przy pomocy IFN typu I nie przynosi większych korzyści w przypadku infekcji MERS-CoV i SARS-CoV. Jednakże komórki zakażone SARS-CoV-2 charakteryzowały się większą, w porównaniu do zakażeń poprzednikami, wrażliwością na terapię. Rodzi to możliwość prowadzenia skutecznej farmakologii przeciwko COVID-19.
Lopinawir i ritonawir
Związki te są inhibitorami proteazy HIV-1, z tym że lopinawir charakteryzuje się wyższą skutecznością w blokowaniu wspomnianego enzymu, a ritonawir dodatkowo blokuje cytochrom p4503A4, spowalniając metabolizm lopinawiru.
Dowiedziono, iż lopinawir hamuje replikację MERS-CoV, SARS-CoV oraz HCoV-229E, a mieszanki lopinawir-ritonawir wraz z rybawiryną używano podczas pandemii drugiego z wymienionych wirusów, co pozwoliło zmniejszyć odsetek pacjentów z zespołem ostrej niewydolności oddechowej. Jednakowoż, mimo że terapia lopinawir-ritonawir in vitro daje obiecujące rezultaty, tak badania kliniczne wykazują niemal brak korzyści ze stosowania tych leków przeciw COVID-19.
Sukces odnieść może natomiast potrójna farmakologia z wykorzystaniem połączenia lopinawir-ritonawir, rybawiryny oraz interferonu β-1b. Okazuje się ona efektywna przy podaniu w ciągu 7 dni od wystąpienia objawów (b.d. dotyczących późniejszego rozpoczęcia farmakologii, przez obawy względem prozapalnego działania IFN-β-1b), a większości pacjentów udało się ozdrowieć wraz z upływem 8 dni od początku terapii. Efekty uboczne były lekkie i samoograniczające się, a leczenie wykazało zauważalnie wyższą skuteczność niż w wypadku stosowania samego lopinawiru wraz z ritonawirem, co jest widoczne na poniższych wykresach.
sACE2
ACE2 (ang. angiotensin II converting enzyme type 2) składa się z dwóch domen: transbłonowej zakotwiczającej białko w błonie komórkowej oraz zewnątrzbłonowej stanowiącej m.in. receptor dla SARS-CoV-2. Dzięki zastosowaniu proteazy ADAM17 (ang. a disintegrin and metalloproteinase 17) można przeciąć wspomniane białko, co powoduje uwolnienie jego zewnętrznej domeny do krwiobiegu. Uzyskany związek nosi miano sACE2 (soluble angiotensin II converting enzyme type 2), a jego nawet niewielkie stężenia wykrywane są we krwi oraz moczu. Potencjalny mechanizm działania substancji polega na uniemożliwieniu wniknięcia wirusa do komórki gospodarza poprzez wiązanie z sACE2. Farmakoterapia sACE2 w połączeniu z fragmentem Fc immunoglobuliny (w celu przedłużenia okresu półtrwania związku) in vitro daje pomyślne rezultaty w neutralizacji SARS-CoV-2, jednak jak dotąd brak dowodów klinicznych na skuteczność tego leczenia.
Antagonisty receptora angiotensyny II
Badanie na myszach wykazało ochronne działanie ACE2 na tkankę płucną. Osobniki, u których wyłączono gen Ace2, cechowały się poważniejszym przebiegiem choroby, niższym stopniem utlenowania krwi, zwiększoną liczbą komórek zapalnych w płucach i olbrzymim obrzękiem tychże narządów w zestawieniu z próbą kontrolną. Podobnie u pacjentów zakażonych SARS-CoV-2, rosnąca ilość angiotensyny II była liniowo skorelowana z uszkodzeniami płuc.
Prawdopodobny wpływ SARS-CoV-2 na ekspresję ACE2 i przebieg COVID-19 wygląda następująco:
- Infekcja.
- Zmniejszenie poziomu ACE2 w skutek nadmiernej stymulacji.
- Przewaga syntezy angiotensyny II nad jej degradacją.
- Intensywniejsze pobudzanie receptora angiotensyny II AT1R (angiotensin II receptor type 1).
- Zwiększenie ciśnienia hydrostatycznego i przepuszczalności naczyń.
- Zwiększenie obrzęku płuc, gorsze rokowania.
Związki, które są antagonistami AT1R, tworzą grupę leków o nazwie ARB (ang. angiotensin receptor blocker) i wykorzystuje się je do leczenia nadciśnienia tętniczego. Ich działanie opiera się na uniemożliwianiu angiotensynie II pełnienia swojej biologicznej roli, polegającej na powodowaniu wazokonstrykcji oraz retencji wody i sodu w organizmie. U chorych przyjmujących przewlekle ARBs (olmesatran i losartan) dochodzi do zwiększenia ekspresji ACE2, przekształcenia angiotensyny II w angiotensynę 1–7, która pobudza receptor mas-R, co powoduje rozkurcz naczyń (Fig.5). Ponadto, angiotensyna 1–7 charakteryzuje się szerokim wachlarzem właściwości przeciwzapalnych i antyoksydacyjnych. Jej niski poziom związany jest z nadciśnieniem, miażdżycą, zawałem serca, neuropatią cukrzycową i uszkodzeniem płuc. Przez to nadciśnienie i cukrzyca często towarzyszą ostrym przypadkom COVID-19.
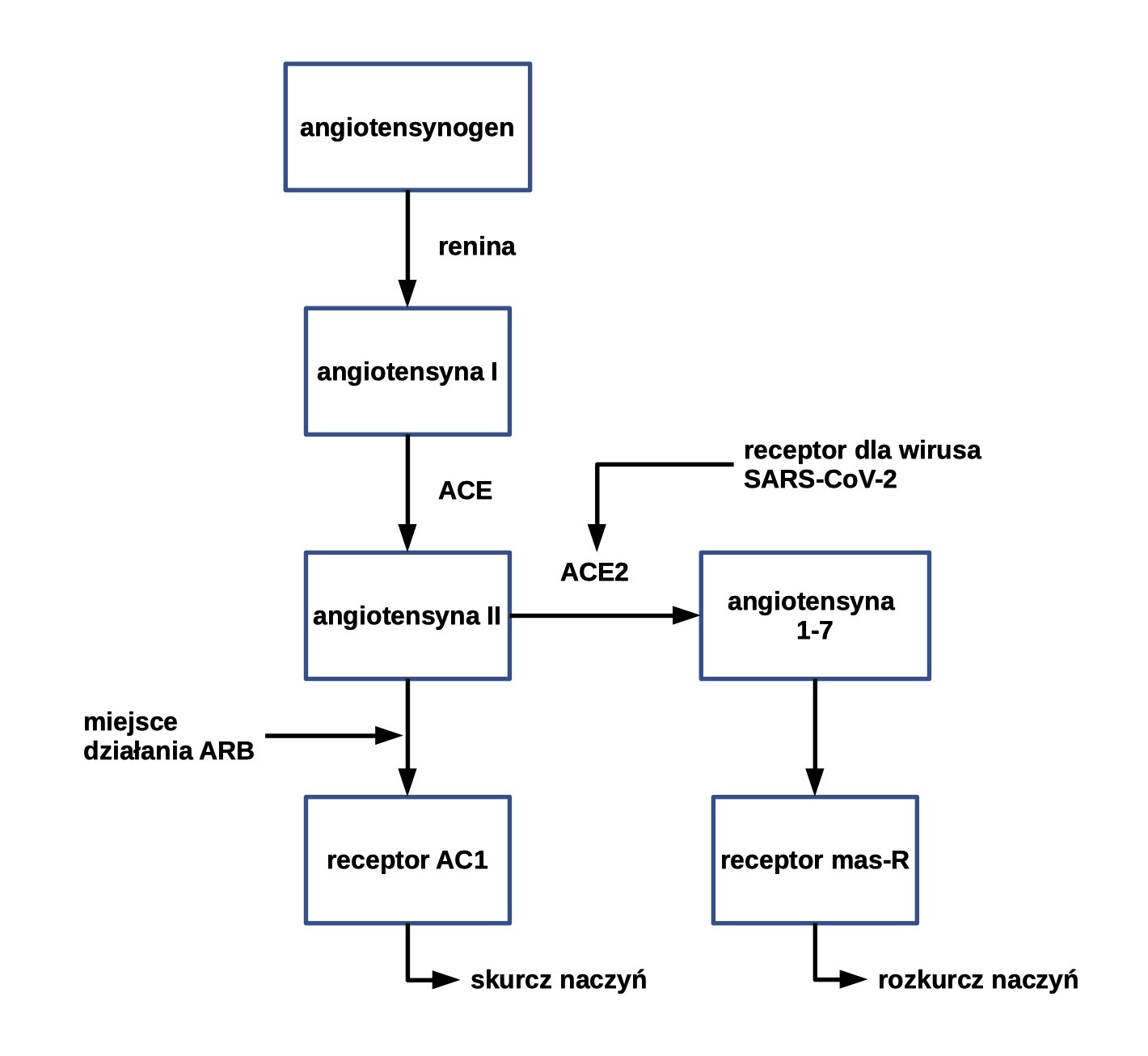
Ryc.1. Schemat szlaku powstawania i metabolizmu angiotensyny.
Łączenie leków ARB z witaminą D może przynieść jeszcze lepsze skutki, ponieważ obie substancje niezależnie podnoszą liczbę ACE2, a dodatkowo wit. D hamuje produkcję reniny (stymulującej sekrecję angiotensynogenu) w odpowiedzi na inhibicję AT1R, przez co powstaje mniej prozapalnej angiotensyny II. Co więcej, cholekalcyferol łagodzi stan zapalny w płucach i wzmaga siłę odpowiedzi przeciwwirusowej. W związku z dużym potencjałem przedstawionej terapii konieczne są badania kliniczne w celu szczegółowego opracowania jej farmakologii.
Podsumowanie
W tym miejscu kończy się nasza magiczna podróż przez nanoświat wirusów oraz makroświat naukowców pracujących nad lekami. Liczę, iż nie tylko ja, ale również i Ty, drogi czytelniku, droga czytelniczko, bawiłeś/bawiłaś się przednio, zgłębiając coraz to kolejne formy terapii i zaspokajając swą żądzę wiedzy. Dziękuję Ci za poświęconą uwagę.
Stay safe.
Bibliografia:
- BRIED Teaching. National Early Warning Score (NEWS) 2. https://briedteaching.wordpress.com/2019/06/20/national-early-warning-score-news-2/ (25.07.2020).
- Fan-Ngai Hung I, Lung KC, Yuk-Keung Tso E, i in. Triple combination of interferon beta-1b, lopinavir–ritonavir, and ribavirin in the treatment of patients admitted to hospital with COVID-19: an open-label, randomised, phase 2 trial. 2020. Lancet 395: 1695–704.
- Rafiullah M, Can a combination of AT1R antagonist and vitamin D treat the lung complication of COVID-19?, 2020. The American Journal of the Medical Sciences. Publikacja online.
- Pawlik L, Śpiołek E, Fichna J, Tarasiuk A. Charakterystyka wirusa SARS-CoV-2 i potencjalne farmakologiczne sposoby leczenia. 2020. Postępy Biochemii 66(2): 83-90.
- Wang Y, Zhang D, Du G, i in. Remdesivir in adults with severe COVID-19: a randomised, double-blind, placebo-controlled, multicentre trial. 2020. Lancet 395: 1569–78.